Blog
老人定期進行癌症檢查有必要嗎? 高齡防癌的檢查建議與風險解析

研究顯示,超過六成的癌症發生在65歲以上族群,年齡本身即為多種癌症的重要危險因子。然而,對高齡者而言,「是否需要定期癌症篩檢」並非一體適用的簡單選項。身體機能、慢性病共病、生活品質目標與篩檢本身的風險,都需納入綜合考量。
本篇文章從臨床角度出發,說明有哪些檢查方式相對安全、適合高齡者實行,依據不同癌症的流行病學數據、年長者常見的共病情況與現行檢查選項,提供實用的防癌檢查建議與風險解析指南,協助您與家中長輩一起做出最合適的防癌決策。
*註:「共病」是指除了主要疾病之外,同時還存在兩種或兩種以上可能影響疾病治療或病情發展的其他健康問題。這些疾病之間可能有關聯,也可能沒有直接關聯,但會交互影響病患的整體健康狀況。
高齡者的癌症機率解析
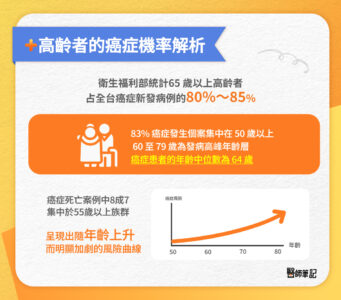
癌症風險與年齡高度相關,隨著年齡增長,罹癌機率也顯著上升。根據衛生福利部統計,65 歲以上高齡者占全台癌症新發病例的 80%~85%,其中以肺癌、大腸癌與肝癌最為常見。
從年齡分布觀察,衛福部 111 年癌症登記報告指出,83% 的癌症發生個案集中在 50 歲以上,而 60 至 79 歲為發病高峰年齡層;癌症患者的年齡中位數為 64 歲。112 年的最新資料亦顯示,癌症死亡案例中,有8成7集中於55歲以上族群,呈現出隨年齡上升而明顯加劇的風險曲線。
在臨床上,高齡者罹癌的原因並非單一因素,而是長期累積性風險的結果。隨著年齡增長,細胞修復能力與基因校正機制逐漸衰退,使得長年累積的 DNA 損傷更容易轉化為癌前病變或惡性腫瘤。同時,高齡者常伴隨多重慢性疾病,如高血壓、糖尿病、心血管疾病、腎功能異常等,這些共病不僅會提升癌症發生風險,也會影響癌症診斷的準確性與治療選擇的彈性。
值得注意的是,許多長者對身體的異常反應容易歸因於「自然老化」,導致忽視癌症初期可能出現的徵兆,如食慾下降、體重減輕、倦怠、排便改變等,進而延誤就醫時機。因此,醫師普遍建議,高齡者仍需做癌症篩檢,並依據個人健康狀況、家族史與生活型態,採取個別化、風險導向的篩檢策略,提升早期發現與介入治療的可能性。
 高齡者的癌症機率解析
高齡者的癌症機率解析
為因應高齡化社會下的健康問題,衛生福利部與臺北市衛生局於今年同步推動擴大版癌症防治政策,特別強化「七大癌症篩檢」項目,並提供符合條件者免費且定期的非侵入性檢查。
目前多數篩檢項目的年齡上限為74歲,主要針對中高齡族群設計,目標是協助民眾在無症狀階段提早發現病灶,降低後續治療風險與死亡率。
這七大癌症之所以被納入高齡優先篩檢項目,是基於其「高發生率」、「高致死率」與「早期發現效果顯著」三大原則,同時也考量了台灣民眾常見的生活習慣、家族病史與病毒感染情形。
1.肺癌篩檢
- 篩檢方式: 低劑量電腦斷層掃描(LDCT),每兩年一次。
- 適用對象:
45至74歲男性、40至74歲女性,若其父母、子女或兄弟姊妹曾罹患肺癌。
50至74歲重度吸菸者(吸菸指數 ≥20 包-年,且仍吸菸或戒菸未滿 15 年)。 - 風險解析:肺癌為台灣癌症死亡首位,特別好發於高齡男性,高風險因子包括長期吸菸、二手菸暴露、空氣污染與職業粉塵暴露等。由於肺癌早期多數無症狀,極易延誤診斷。2011年刊登於《New England Journal of Medicine》的NLST大型臨床研究證實,高風險族群若定期接受LDCT掃描,可降低肺癌死亡率達15~20%,並顯著提升第一期早期診斷率。
2.乳癌篩檢
- 篩檢方式:每兩年一次乳房X光攝影(Mammography)。
- 適用對象: 40至74歲女性。
- 風險解析:乳癌是高齡女性最常見的惡性腫瘤,隨著年齡上升,乳房組織退化、荷爾蒙變化與肥胖皆為風險因素。乳癌初期常無明顯症狀,定期攝影能有效提升早期發現機會。2023年《JAMA Oncology》研究顯示,身體健康良好的高齡女性若持續接受乳癌篩檢,死亡風險可降低約20%。
3.子宮頸癌篩檢
- 篩檢方式:
子宮頸抹片檢查(Pap smear):每三年一次。
人類乳突病毒檢測(HPV DNA):針對 35、45、65 歲女性提供一次。 - 適用對象:
25 歲以上女性(抹片檢查)。
35、45、65 歲女性(加做 HPV 檢測)。 - 風險解析:子宮頸癌雖多見於中年女性,但對未定期接受篩檢或曾感染 HPV 的高齡女性而言,風險仍不可忽視。隨著年齡增長與免疫力下降,潛伏體內的高危型 HPV 病毒可能再度活化,導致癌前病變甚至惡化為子宮頸癌。
2023 年刊登於《Journal of Gynecologic Oncology》的系統性回顧指出,抹片檢查結合 HPV DNA 檢測,可降低 50% 以上的癌前病變進展風險。
4.大腸癌篩檢
- 篩檢方式:每兩年一次糞便潛血檢查(FOBT)。
- 適用對象:
45至74歲一般民眾。
40至44歲具家族史者。 - 風險解析:大腸癌在高齡族群的發生率與死亡率皆高,通常由腺瘤性瘜肉歷經5~10年轉變而來。早期常見徵兆如血便、排便頻率改變等,容易被誤以為是腸胃功能退化。2020年《The Lancet》研究指出,70–79歲定期接受糞便潛血檢查或大腸鏡檢查者,其大腸癌發生率下降約40%,死亡風險下降約30%。台灣110年健保數據亦發現逾3萬名癌前病變個案,驗證篩檢實效。
5.口腔癌篩檢
- 篩檢方式:每兩年一次口腔黏膜視診。
- 適用對象:
30歲以上嚼檳榔、戒檳榔或吸菸民眾
18至29歲原住民中具嚼檳榔經驗者 - 風險解析:台灣為全球少數口腔癌高發國家,尤其以高齡男性為主要風險族群,嚼檳榔與吸菸是主要成因。許多早期病灶(如口腔潰瘍、紅白斑)常遭忽略。2022年《Journal of the Formosan Medical Association》研究指出,定期口腔黏膜檢查可提升早期發現機率,使五年存活率達80%,遠高於晚期診斷的20%~30%。
6.肝癌篩檢
- 篩檢方式:B/C型肝炎病毒抽血檢查(終身一次)。
- 適用對象:45至79歲從未檢驗過B型或C型肝炎者。
- 風險解析:台灣為肝炎盛行區,估計15%高齡者為B型肝炎帶原者,若未追蹤治療,恐演變為肝硬化甚至肝癌。2022年《Hepatology》研究指出,對帶原者進行定期腹部超音波與AFP檢查,可使肝癌五年存活率從10%提高至50%以上,顯著改善預後。
7.胃癌篩檢
- 篩檢方式:幽門螺旋桿菌糞便抗原檢查(終身一次)。
- 適用對象: 45至74歲民眾。
- 風險解析:幽門螺旋桿菌為高風險致癌因子,長期感染可能導致慢性胃炎、胃潰瘍甚至胃癌,台灣高齡者感染率偏高。2023年《Gastroenterology》研究指出,根除幽門桿菌可降低胃癌風險達30%~50%,在無症狀情況下完成一次性篩檢與除菌治療,可有效預防後續癌變。
 其他需關注的高齡癌症類型
其他需關注的高齡癌症類型
除了衛生福利部推動的七大公費癌症篩檢項目,許多醫事檢驗所與健檢中心亦提供自費型進階篩檢方案,涵蓋更多種類的癌症偵測。特別對於65 歲以上族群而言,仍有部分癌症因無常規篩檢、初期症狀不明顯、或缺乏認知而容易被忽略,導致延誤診斷。
根據台灣癌症登記中心(TCR)與臨床實務觀察,以下四類癌症在高齡者中具較高發生率或致死率,建議特別留意:
1.胰臟癌
- 篩檢方式: 腹部超音波檢查、電腦斷層掃描(CT)。
- 適用對象:65 歲以上具以下高風險因子者:新發糖尿病或血糖控制突然惡化、慢性胰臟炎病史、胰臟癌一等親家族史、不明原因體重減輕、食慾減退。
- 風險解析:根據台灣111年癌症登記報告,胰臟癌首次進入十大癌症排名第10,在65歲以上族群中發生率上升,標準化發生率約為每10萬人15-20例。胰臟癌死亡率高,五年的存活率僅約5%-10%。由於初期症狀極不典型,且目前無有效普篩工具,約八成患者確診時已為晚期,高齡者若能針對高風險條件進行個別化監測,有助於早期發現。
2.攝護腺癌(前列腺癌)
- 篩檢方式: 前列腺特異抗原(PSA)血液檢查。
- 適用對象:65 歲以上男性,特別是具以下情況者:攝護腺癌家族史、排尿困難、頻尿、夜尿加劇。
- 風險解析:攝護腺癌是高齡男性常見癌症,111年癌症登記報告顯示其為男性第五大癌症,65歲以上族群標準化發生率約為每10萬人100-150例。雖然死亡率相對較低(五年存活率約80%),但高齡者因共病影響,治療挑戰較大。2021《The Lancet Oncology》研究指出,攝護腺癌在70-80歲族群中發生率高達40%,早期篩檢可提高存活率,但需謹慎評估過度診斷與不必要治療風險。
3.膀胱癌
- 篩檢方式: 尿液常規+離心鏡檢;有症狀或高風險者可考慮膀胱鏡、尿液細胞學、泌尿系統超音波。
- 適用對象:65 歲以上男性,特別是具以下風險者:長期吸菸(包括已戒菸者)、曾從事化學品暴露工作(如染料、橡膠、油漆工)、有反覆膀胱炎或不明血尿病史。
- 風險解析:111年癌症登記報告顯示其為男性第七大癌症,65歲以上族群發生率約為每10萬人20-30例,五年的存活率約60%-70%,高齡者因免疫力下降,復發率較高。2023年《European Urology》研究顯示,膀胱癌在70歲以上族群的發生率隨年齡增長顯著上升,早期發現可避免侵入性治療。
高齡防癌篩檢注意事項
隨著年齡的增加,許多高齡者(特別是60歲以上)同時面臨多種慢性疾病,例如高血壓、心臟病、糖尿病或腎功能異常,這些健康狀況不僅影響癌症的風險,也直接影響篩檢的選擇與結果判讀的正確性。因此,在安排癌症篩檢時,高齡者需要更「個人化」的決策與風險評估。
1.個人化選擇
並非所有高齡者都適合接受常規的標準癌症篩檢,尤其是需鎮靜或麻醉的侵入性檢查(如大腸鏡、胃鏡),對心肺功能較差的長者而言,可能引發心律不整、低血壓、呼吸抑制等併發症。此外,若合併慢性發炎或肝腎功能異常,也可能影響腫瘤標記(如 CEA、CA-125 等)的準確度,導致偽陽性或偽陰性結果,進而引起不必要的醫療介入與心理壓力。
建議高齡者應與醫師共同討論最適合的篩檢策略,根據個人體能狀況、共病情形與家族病史,量身擬定檢查計畫,優先考慮低風險、非侵入性的初步評估工具。
除了衛服部的七癌篩檢,健檢中心常提供的癌症篩檢套餐中,包含多項高解析度影像工具,適合用來輔助早期診斷,例如:
- 磁振造影(MRI):頭頸部、乳房、子宮卵巢、攝護腺、全腹部、脊椎。
- 電腦斷層(CT):肺部、頭部、心臟、腹部、頭頸部。
- 無痛胃腸鏡:視患者狀況評估是否適合進行。
- DR-70 血液檢測:針對無法耐受侵入性檢查的高齡者,DR-70 是一項適用於多癌別的非侵入性血液篩檢工具,僅需抽血即可,檢查過程安全、簡便,有助於初步風險評估。
2.避免過度檢查
對於體弱或曾有麻醉不良反應的高齡者,即使篩檢結果呈現中度風險,也不一定需要立即進行侵入性檢查。可考慮採用非侵入性影像或分階段觀察,再決定是否進一步處置。避免因過度檢查導致身體負擔,也可選擇創新檢測工具DR-70 血液檢查作為補充篩檢。
DR-70 是一種創新的癌症早期篩檢血液檢測技術,目標為檢測癌細胞活動時釋放的纖維蛋白降解產物(FDP)。不同於傳統腫瘤指標,DR-70 可反映整體腫瘤相關的系統性變化,靈敏度達85%~90%,涵蓋多種癌別(如肺癌、大腸癌、肝癌、乳癌、胃癌),檢查方式僅需抽血,無需空腹、不需麻醉,也無侵入性風險,特別適合無法承受高負擔檢查的年長者。
若DR-70初次檢查結果顯示略高、但影像無異常,也可考慮3~6個月後重新檢測進行動態觀察,追蹤FDP變化趨勢。
定期篩檢雖重要,但不應取代對自身變化的觀察。若出現以下癌症可能的警訊,即使未達篩檢資格,也應儘速就醫檢查,包含:體重突然下降、長期且無明確原因的疼痛、不明原因出血(如陰道、便血、痰血)、排便或排尿習慣明顯改變。
 高齡防癌的補充建議
高齡防癌的補充建議
除了定期接受癌症篩檢,高齡者在日常健康管理上,亦應同步落實「基礎健康檢查」、「疫苗接種」與「生活型態調整」三大策略,才能從全方位降低癌症發生與併發風險。根據世界衛生組織(WHO)指出,健康生活方式的落實有機會降低約 30%~50% 的癌症發生機率。
1.基礎健康檢查:監控慢性病、提升篩檢準確性
隨著年齡增加,高齡者罹患高血壓、糖尿病、腎功能不全等慢性疾病的風險顯著上升,這些疾病不僅本身為某些癌症的危險因子,也可能干擾癌症篩檢結果的判讀。建議每年接受一次基礎健康檢查,項目可涵蓋:血壓、血糖、血脂、肝腎功能、心電圖、尿液分析、血紅素濃度。
2.疫苗接種:鞏固免疫力、預防慢性發炎
年齡增長會導致免疫力下滑,使高齡者更易受到病毒感染,引發慢性發炎反應。長期慢性發炎已被證實與多種癌症(如肝癌、肺癌、大腸癌)密切相關。
因此,建議高齡者在諮詢醫師後接種以下三類疫苗:
- 流感疫苗:每年接種一次,可有效預防季節性流感及相關重症併發症。
- 肺炎鏈球菌疫苗:能預防肺炎、菌血症與敗血症,對慢性病患者與 65 歲以上族群具高度保護力。
- COVID-19 疫苗:有助降低感染後出現重症、住院或死亡的風險,對免疫功能下降者尤為重要。
3.生活型態調整:從源頭降低癌症與慢性病風險
改變生活習慣仍是預防癌症最具實證與成本效益的策略之一。根據《美國癌症學會(ACS)》的建議,下列三項日常實踐對降低癌症風險具有顯著效益:
戒菸與限酒:吸菸與酗酒是多種癌症(如肺癌、口腔癌、肝癌等)明確的致癌因子。即使在高齡階段戒除,亦能降低罹癌風險。
控制體重與維持規律活動:肥胖與久坐生活與乳癌、大腸癌、胰臟癌等風險增加有關。建議每週進行至少 150 分鐘中等強度運動(如快走、游泳),以促進代謝與心肺功能。
均衡飲食:多攝取蔬果、全穀與豆類,減少紅肉、加工肉與高糖食品的攝入,有助於抑制慢性發炎。
結論
隨著年齡增長,罹癌風險確實上升,但對於高齡者而言,癌症的管理策略應更強調「早期發現、適度介入與生活品質的維持」。並非所有癌症都需要積極治療,例如攝護腺癌等生長緩慢、無臨床症狀的腫瘤,經常可採取密切追蹤、延後處置的方式,避免過度醫療所帶來的風險與身體負擔。
高齡防癌的重點,在於透過個人化、低風險的篩檢工具,及早識別可能威脅健康的變化,並與醫療團隊共同討論最合適的處置策略。透過篩檢選擇與生活型態調整,即便在晚年階段,仍有機會延緩疾病進程,提升生活品質。
參考文獻
1.National Cancer Institute. (2020). Cancer statistics: Age and cancer. Surveillance, Epidemiology, and End Results Program. https://seer.cancer.gov/statfacts/html/all.html
2.National Lung Screening Trial Research Team. (2011). Reduced lung-cancer mortality with low-dose computed tomographic screening. New England Journal of Medicine, 365(5), 395–409. https://doi.org/10.1056/NEJMoa1102873
3.Kerlikowske, K., Zhu, W., Tosteson, A. N. A., Sprague, B. L., Tice, J. A., Lehman, C. D., & Miglioretti, D. L. (2023). Association of screening with digital breast tomosynthesis vs digital mammography with risk of interval invasive and advanced breast cancer. JAMA Oncology, 9(6), 772–781. https://doi.org/10.1001/jamaoncol.2023.0434
4.Zhang, J., Zhao, Y., & Dai, Z. (2023). Cervical cancer screening and prevention in low-resource settings: A review of recent advances. Journal of Gynecologic Oncology, 34(4), e54. https://doi.org/10.3802/jgo.2023.34.e54
5.Senore, C., Basu, P., Anttila, A., Ponti, A., Tomatis, M., Vale, D. B., … & Segnan, N. (2020). Colorectal cancer screening with faecal immunochemical testing, sigmoidoscopy or colonoscopy: A microsimulation modelling study. The Lancet, 396(10260), 1273–1282.
6.Chuang, S.-L., Su, W. W.-Y., Chen, S. L.-S., Yen, A. M.-F., & Wang, P.-C. (2022). Oral cancer screening in Taiwan: Current status and future perspectives. Journal of the Formosan Medical Association, 121(8), 1503–1511. https://doi.org/10.1016/j.jfma.2022.02.011
7.Singal, A. G., Zhang, E., & Narasimman, M. (2022). Ultrasound and alpha-fetoprotein screening for hepatocellular carcinoma: A systematic review. Hepatology, 76(4), 1156–1168. https://doi.org/10.1002/hep.32364
8.Liou, J.-M., Malfertheiner, P., Lee, Y.-C., Sheu, B.-S., Sugano, K., Cheng, H.-C., … & El-Omar, E. M. (2023). Helicobacter pylori eradication and gastric cancer risk: A meta-analysis. Gastroenterology, 164(6), 909–920. https://doi.org/10.1053/j.gastro.2022.12.014
9.Evans, D. B., & Abbruzzese, J. L. (2022). Pancreatic cancer: Challenges and opportunities in 2022. Journal of Clinical Oncology, 40(16), 1743–1751. https://doi.org/10.1200/JCO.21.02627
10.Hamdy, F. C., Donovan, J. L., Lane, J. A., Mason, M., Metcalfe, C., Holding, P., … & Neal, D. E. (2021). Active monitoring, radical prostatectomy, or radiotherapy for localised prostate cancer: 10-year outcomes from the ProtecT trial. The Lancet Oncology, 22(6), 766–777.
11.Babjuk, M., Burger, M., Capoun, O., Cohen, D., Compérat, E. M., Dominguez Escrig, J. L., … & Witjes, J. A. (2023). European Association of Urology guidelines on non-muscle-invasive bladder cancer (TaT1 and carcinoma in situ). European Urology, 83(1), 73–83.

 高齡者的癌症機率解析
高齡者的癌症機率解析 其他需關注的高齡癌症類型
其他需關注的高齡癌症類型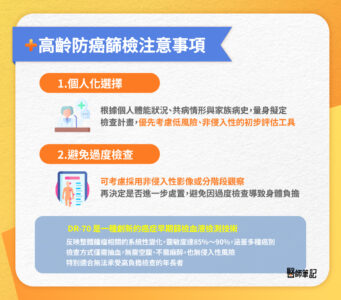 高齡防癌的補充建議
高齡防癌的補充建議